每日外闻110
遗传因素会影响精神分裂症的发生发展,最近的全基因组关联分析鉴定出了 α3, α5 和 β4 nAChR 亚基的等位基因突变会增加患精神分裂症的风险。α5 nAChR 亚基的的SNP:rs16969968(α5SNP)会导致部分突变的nAChRs功能丧失,增加精神分裂症的风险。有趣的是,这个基因多态性(SNP)也增加了烟草依赖的风险。这表明α5* nAChR信号缺失可能与这些合并症相关。但是,关于α5* nAChRs在大脑中的功能的了解相对较少。这反映了一个事实,即α5nAChR亚基以较少的水平表达,并在大脑中显示出受限的表达模式。为了解决这一重要的知识鸿沟,Koukouli等人在小鼠中研究了α5* nAChRs在精神分裂症患者中观察到的细胞和行为的缺陷机制。
他们首先构建了携带这个SNP的老鼠,他们发现携带这个SNP的老鼠表现出和精神分裂症相似的行为-社交功能障碍和感觉运动门控障碍。
接下来,使用体内双光子钙成像技术研究了α5* nAChRs在调节PFC(前缘区域)活性中的作用,该技术可使单个锥体神经元可视化并监测其活动。与野生型小鼠相比,α5SNP小鼠以及α5KO小鼠中,PFC的II / III层中的锥体神经元活性显着降低。在精神分裂症患者死后的大脑中发现了II / III层中GABAergic神经元功能的缺陷。因此,α5SNP小鼠皮层活动的破坏与精神分裂症患者皮层中所见的所谓默认网络活动(称前额页功能低下)的缺陷一致。
在PFC的II / III层中,α5nAChR亚基仅由VIP内部神经元表达,它们对另外两种抑制性内部神经元提供抑制性驱动:生长抑素(SOM)和小白蛋白(PV)内部神经元。 PV和SOM中间神经元通过密集的局部连通性强烈抑制锥体神经元,而小鼠PFC中的VIP中间神经元接触锥体神经元的频率低于PV和SOM中间神经元。根据这种细胞排列,Koukouli等人假设破坏VIP神经元中的α5* nAChR信号传导会降低这些细胞的活性,进而抑制PFC中的SOM和/或PV中间神经元,从而增加对局部锥体神经元的抑制性驱动。与此假设相符,仅在缺乏α5的小鼠的II / III层的GABA能神经元中选择性地重新表达野生型α5亚基,锥体神经元活性将完全恢复到野生型小鼠中所见的水平,而当α5SNP在缺乏α5的小鼠的PFC GABA能神经元中表达时,只能看到部分椎体神经元活性的恢复。
接下来,Koukouli等人采用了一种elegant的基因组编辑方法,使用CRISPR–Cas9敲除PFC中的α5-nAChR亚基转录本,以研究α5* nAChRs控制锥体细胞活性的精确细胞事件序列。在PFC中。他们的研究结果还表明,α5* nAChRs参与VIP内部神经元的应答,而VIP内部神经元又优先通过SOM内部神经元来调节锥体神经元的活性。如下图所示:
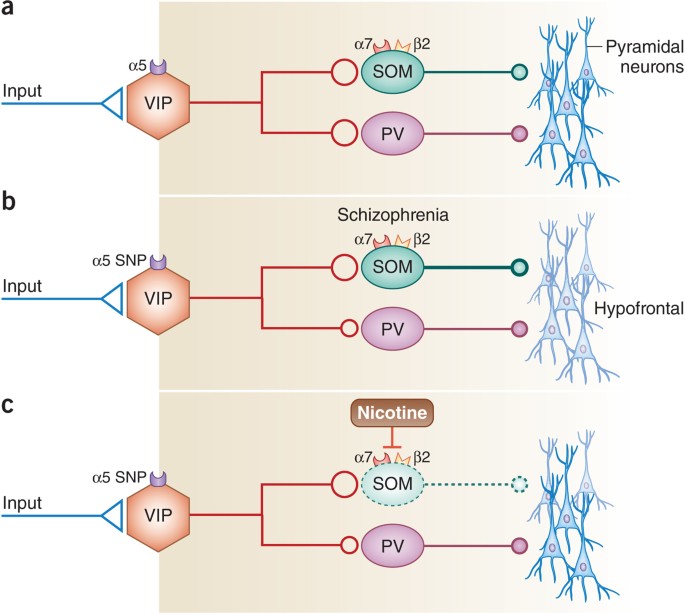
(a)a5 * nAChRs在PFC的II / III层中由VIP中间神经元表达,在那里它们调节向SOM和PV中间神经元的抑制性GABA能驱动。 VIP内部神经元优先通过SOM内部神经元来刺激锥体神经元活动。
(b) a5 * nAChRs(α5SNP)中与精神分裂症相关的多态性会降低VIP中神经元抑制SOM中神经元的活性。这抑制了锥体神经元的活动,导致精神分裂症样前额叶功能低下。
©尼古丁使位于SOM内部神经元上的b2 * nAChRs脱敏,从而降低这些中间神经元的活性,从而减轻了与α5SNP nAChRs相关的SOM内部神经元的过度活跃。
See you tomorrow