每日外闻84
How does coronavirus kill? Clinicians trace a ferocious rampage through the body, from brain to toes
How does coronavirus kill? Clinicians trace a ferocious rampage through the body, from brain to toes
冠状病毒是如何杀死人的?临床医生们追踪了病毒在整个身体的扩散和侵袭。

计算机断层扫描的3D模型显示,冠状病毒对一名死于乔治华盛顿大学医院的59岁男子的肺部造成了大面积损害(黄色)。
杜兰大学医学院的肺科和重症监护(critical care)医生乔舒亚·丹森(Joshua Denson)最近在一个有20个床位的重症监护病房(ICU)查房时,对两名癫痫患者进行了检测评估,其中许多人患有呼吸衰竭,还有一些人的肾脏正处于危险的衰竭状态。几天前,他的团队试图救活一名心脏停止跳动的年轻女子,但失败了。丹森(Denson)说,他们都有一个共同点。“他们都感染了新型冠状病毒。”
随着全球确诊的covid19病例数量激增-超过220万确诊,死亡人数超过15万,临床医生和病理学家正在努力了解冠状病毒对人体造成的损害。他们意识到,虽然肺部是病毒的感染的起点,但它可以扩散到许多器官,包括心脏和血管、肾脏、肠道和大脑。
耶鲁大学和耶鲁-纽黑文医院的心脏病学家Harlan Krumholz说:“这种病毒几乎可以攻击人体内的任何东西,并带来毁灭性的后果。它的凶猛程度令人惊叹。”
理解病毒如何侵袭的人体可以帮助一线医生治疗那些陷入绝望、有时神秘生病的感染者。新近观察到的危险的凝血倾向是否会将一些轻微的病例转变为危及生命的紧急状况?在最严重的病例背后,是否存在一种过度的免疫反应,从而使用免疫抑制药物可能有所帮助?如何解释一些医生报告的患者血氧水平低得惊人,但他们却没有呼吸困难?宾夕法尼亚大学医院的肺部疾病专家Nilam Mangalmurti说:当我们开始考虑治疗方案时,采用系统的方法可能是有益的。
以下是关于病毒如何攻击人体细胞的快速发展的认识,特别是在大约5%的危重病人身上。尽管现在每周都有超过1000篇论文在期刊投稿,1000篇论文在等待发表,但由于病毒的表现就像人类从未见过的微生物一样,所以很难有一个清晰的认识的画面。如果没有更大规模的前瞻性对照研究,科学家们就必须从小型研究和案例报告中获取信息,这些研究和案例报告以惊人的速度发表,而且往往没有同行的评审修订。“随着这种现象的发展,我们需要保持一种非常开放的心态,我们仍在学习。”目前正在治疗19例covid19患者的拉什大学医学中心(Rush University Medical Center)肝脏移植医生南希·罗(Nancy Reau)说。
感染的开始
当被感染者咳出携带病毒的飞沫,被其他人吸入后,新型冠状病毒(SARS-CoV-2)就会进入鼻腔和咽喉。根据韦康桑格研究所(Wellcome Sanger Institute)和其他机构的科学家的研究资料表明,它在鼻子内壁找到了一个受欢迎的归宿。他们发现那里的细胞富含一种叫做血管紧张素转换酶2 (ACE2)的细胞表面受体。在人体各处,ACE2的存在标志着组织易受感染,因为病毒需要这种受体进入细胞。ACE2通常情况下有助于调节血压。病毒一旦进入细胞内部,就会劫持细胞的这个“工厂”,复制无数个自己,并侵入新的细胞。
随着病毒的繁殖,感染者可能会排出大量的病毒,特别是在第一周左右。此时可能还没有临床上的感染症状。或者,病毒的新宿主可能会出现发烧、干咳、喉咙痛、嗅觉和味觉丧失,或者头痛和身体疼痛。
如果免疫系统在病毒感染的最初阶段没有击退它(SARS-CoV-2),那么病毒就会沿着气管向下蔓延,攻击肺部,进而导致死亡。肺呼吸树的较细、较远的分支一直延伸到称为肺泡的微小气囊中,每个气囊由单层细胞排列,这些细胞也富含ACE2受体。
正常情况下,氧气通过肺泡进入毛细血管-位于肺泡旁的微小血管,然后氧气被输送到身体的其他部位。但是当免疫系统与入侵者作战时,战斗本身就会破坏这种正常的氧气传输。战斗前线的白细胞释放一种叫做趋化因子的炎症分子,这些趋化因子反过来又会召唤更多的免疫细胞来瞄准并杀死被病毒感染的细胞,留下大量的液体和死细胞-也就是脓汁。这是肺炎的基本病理过程,其伴有有相应的症状:咳嗽、发烧、呼吸又快又浅。一些covid19患者可以康复,但有时只能依靠呼吸机的鼻套管吸入氧气。
但是其他的病情恶化,像一种叫做急性呼吸窘迫综合症(ARDS)的疾病发病通常是很突然的。这种疾病的患者血液中的氧气含量急剧下降,相比于普通肺炎患者,呼吸变得更加困难。在x光和计算机断层扫描中,他们的肺部满是白色的混浊物,而在正常的肺中,这些混浊物的位置本该是黑色-表示这个部位有空气。一般情况下,这些病人最终需要使用呼吸机来帮助呼吸。他们中有很大一部分的人都死了。尸检结果显示,他们的肺泡中充满了液体、白细胞、粘液和被破坏的肺细胞的碎屑(见图)。

新型冠状病毒对人体的影响
严重情况下,SARS-CoV-2会进入肺部,对肺部造成严重损害。但是这种病毒,或人体对它的反应,会伤害许多其他器官。科学家们才刚刚开始探索这种危害的范围和性质。
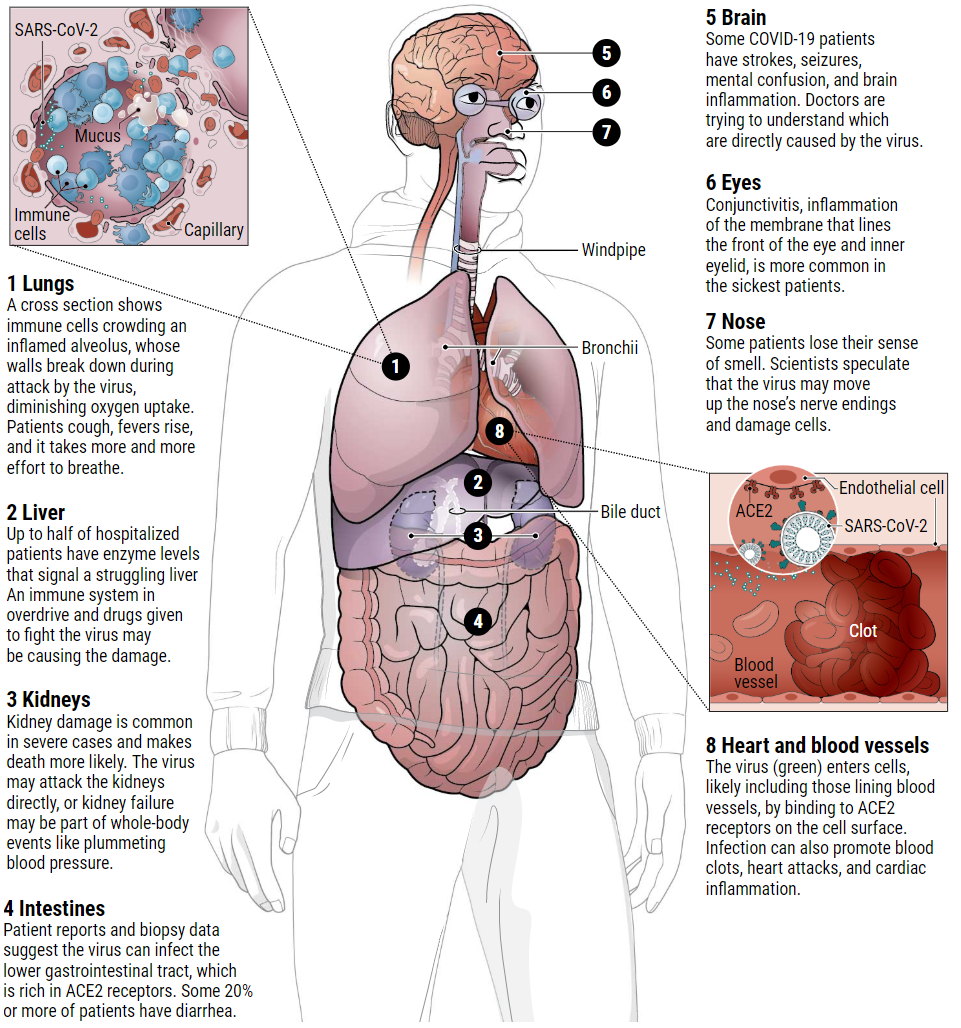
一些临床医生怀疑,许多重症患者病情恶化的驱动力是免疫系统灾难性的过度反应,这种反应被称为“细胞因子风暴”,其他病毒感染也会引发这种风暴。细胞因子是引导健康免疫反应的化学信号分子;但在细胞因子风暴中,某些细胞因子的水平飙升,远远超过所需水平,免疫细胞开始攻击健康组织。随之血管破裂,血压下降,血栓形成,灾难性的器官衰竭会随之而来。
一些研究表明,住院的COVID-19患者血液中这些炎症诱导细胞因子水平升高。坦普尔大学医院(Temple University Hospital)负责照料19名covid19患者的肺科医生杰米•加菲尔德(Jamie Garfield)表示:“这种疾病的实际发病率和死亡率可能是由人体对这种病毒的过度炎症反应驱动的。”
但其他人对这种说法并不信服。斯坦福大学医学院(Stanford University School of Medicine)肺部危重症护理医师约瑟夫•莱维特(Joseph Levitt)表示:“人们似乎很快就将COVID-19与这些炎症反应联系了起来,但我还没有看到令人信服的数据证明这一点。”
他还担心抑制细胞因子反应的努力可能会适得其反。针对特定细胞因子的几种药物已经进入了COVID-19患者的临床试验。但是莱维特担心这些药物可能会抑制人体对抗病毒所需的免疫反应。莱维特说:“这种针对细胞因子的药物允许更多的病毒复制,这确实存在风险。”
与此同时,其他科学家正在把注意力集中在一个完全不同的器官系统上,他们说,这个系统导致了一些病人的病情迅速恶化:心脏和血管系统。
直击心脏
在意大利布雷西亚(Brescia),一名53岁的妇女走进当地医院的急诊室,出现了心脏病发作的所有典型症状,包括心电图出现明显的体征,血液中的一种血液标志物表明心肌受损。进一步的测试显示心脏肿胀和瘢痕,左心室(通常是心脏的动力室)非常虚弱,只能泵出正常数量血液的三分之一。但是,当医生在冠状动脉注射染料,寻找可能导致心脏病发作的阻塞物时,他们没有发现任何异常。另一项测试揭示了原因:这名女子感染了COVID-19。
病毒如何攻击心脏和血管是一个谜,但数十份预印文章和论文证明了这种损害是常见的。3月25日发表在《美国医学会杂志心脏病学》(JAMA Cardiology)上的一篇论文记录了中国武汉416例住院的covid19患者中近20%的患者出现了心脏损伤。在武汉的另一项研究中,138名住院患者中有44%患有心律失常。
这种破坏似乎延伸到了血液本身。根据4月10日发表在《血栓形成研究》(Thrombosis Research)杂志上的一篇论文,在一家荷兰重症监护病房的184名covid19患者中,38%的患者血液凝结异常,近三分之一的患者已经有了血栓。血凝块会破裂并进入肺部,堵塞重要的动脉,这种情况被称为肺栓塞。据报道,肺栓塞已导致19名患者死亡。动脉血栓也会进入大脑,导致中风。哥伦比亚大学医学中心心血管医学研究员贝努德•比克德利(Behnood Bikdeli)说,许多患者体内d -二聚体含量高得惊人,这是一种血凝块的副产品。
Bikdeli说:“我们观察得越多,就发现血凝块越可能是导致COVID-19疾病严重程度和死亡率的主要因素。”
感染也可能导致血管收缩。有报告显示,受感染者手指和脚趾出现了局部缺血——血液流动减少,可能导致肿胀、手或脚指疼痛和组织死亡。
肺部血管的收缩可能有助于解释由covid19引起的肺炎中出现的一种令人困惑的现象:一些患者的血氧水平极低,但并没有喘不过气来的症状。在疾病的某些阶段,这种病毒可能会改变帮助调节血压的激素的微妙平衡,并收缩通向肺部的血管。因此,收缩的血管而不是阻塞的肺泡阻止了氧气的吸收。Levitt说:“有一种理论认为病毒会影响血管,这就是为什么我们看到氧气水平如此之低的原因”。
如果COVID-19靶向作用于血管,这也可以帮助解释为什么那些先前就有血管损伤的患者,例如糖尿病和高血压患者,会有更高的严重疾病风险。美国疾病控制与预防中心(CDC)最近对美国14个州住院病人的数据分析发现,约有三分之一的人患有慢性肺病,患有糖尿病的人也大概有这么多,而足足有一半的人曾患有高血压。
Mangalmurti说,她对宾夕法尼亚大学医院(HUP)ICU里没有大量哮喘患者或其他呼吸道疾病患者感到吃惊。“让我们非常震惊的是,风险因素似乎是血管:糖尿病、肥胖、年龄、高血压(这些因素都会改变血管的状态)。”
科学家们正在努力研究到底是什么导致了心血管损伤。这种病毒可能会直接攻击心脏和血管的内膜,这些内膜像鼻子和肺泡一样富含ACE2受体。或者可能是由于肺部混乱造成的缺氧损害了血管。或者细胞因子风暴会像破坏其他器官一样破坏心脏。
“我们还在起步阶段,”克鲁姆霍尔兹说。“我们真的不知道谁会对病毒感染比较脆弱,为什么有些人受到如此严重的影响,为什么疫情来得如此迅速……为什么(有些人)很难康复。”
攻击身体的多个部位
全球范围内对呼吸机短缺(肺功能衰竭患者使用)的担忧引起了广泛关注。而对另一种设备——透析机的争抢就不那么激烈了。纽约大学朗格尼医学中心的神经学家弗龙特拉(Jennifer Frontera)说,如果这些人不是死于肺衰竭,那么他们就是死于肾功能衰竭。该中心治疗了数千名covid19患者。她所在的医院正在开发一种使用不同设备的透析方案,以支持更多的患者。需要透析的原因可能是因为肾脏富含ACE2受体,是另一个病毒的作用靶点。
据一项文章报道显示,武汉85名住院患者中有27%患有肾衰竭。另一份报告称,在中国湖北和四川两省近200名住院的covid19患者中,59%的患者尿液中含有蛋白质,44%的患者有血液;这两种情况都表明肾脏受损。那些患有急性肾损伤(AKI)的COVID-19患者,其死亡率是没有急性肾损伤的COVID-19患者的5倍多。

意大利的医护人员正在重症监护病房照顾一名19岁的covid19患者。
中国科学院苏州生物医学工程技术研究所神经科学家、该研究报道的共同作者贾洪波说:“肺是病毒主要的战场。但是一小部分病毒可能会攻击肾脏。就像在真实的战场上一样,如果两个地方同时受到攻击,每个地方都会变得更糟。”
有一项研究显示,在尸检的肾脏电子显微照片中发现了病毒颗粒,这表明肾脏被病毒直接的攻击过。但肾脏损伤也可能是附带损害。呼吸机增加了肾脏损伤的风险,抗病毒化合物包括瑞昔韦也会增加肾脏损害的风险,后者正在试验用于COVID-19患者。细胞因子风暴还能显著减少流向肾脏的血液,造成通常是致命的损害。而像糖尿病这样已经存在的疾病会增加肾脏受伤的几率。西北肾脏中心的首席医疗官Suzanne Watnick说,有很多已经患有慢性肾脏疾病的人有更高的急性肾脏损伤的风险。
损伤大脑
COVID-19患者的另一组显著的症状集中在大脑和中枢神经系统。弗龙特拉说,她所在的医院需要神经科医生来评估5%到10%的冠状病毒患者。但她说,这“可能严重低估了”那些大脑处于斗争状态的人数,尤其是因为许多人使用了镇静剂和呼吸机。
弗龙特拉曾见过患有脑炎性脑炎,癫痫发作和“交感神经风暴”的患者,这是一种交感神经系统反应过度,可引起癫痫样症状,在脑外伤后最常见。一些COVID-19的患者会短暂地失去意识。其他会短暂失去意识的人一般患有中风。许多COVID-19的患者说他们失去了嗅觉。弗龙特拉和其他人想知道,在某些情况下,感染是否会抑制感觉氧气缺乏的脑干反射。这是对轶事性观察的另一种解释,即一些患者尽管血氧水平低到有生命危险的程度,但并没有气喘吁吁地呼吸空气。
约翰斯·霍普金斯医学院的重症监护医师罗伯特·史蒂文斯(Robert Stevens)说,ACE2受体存在于神经皮层和脑干中。但目前还不清楚病毒是在什么情况下穿透大脑并与这些受体相互作用的。也就是说,2003年非典(SARS)流行背后的冠状病毒—今天的罪魁祸首-COVID-19的近亲—可能会渗入神经元,有时还会引起脑炎。4月3日,《国际传染病杂志》(International Journal of Infectious Diseases)上刊登了一个来自日本的研究小组的案例研究报告。报告显示,在一名罹患脑膜炎和脑炎的covid19患者的脑脊液中发现了新冠状病毒的踪迹,这表明该病毒也可以穿透中枢神经系统。

*一名患有COVID-19的58岁女性患了脑炎,导致大脑组织受损(箭头)*N. POYIADJI ET AL., RADIOLOGY, (2020) DOI.ORG/10.1148/RADIOL.2020201187
但是其他因素可能会损害大脑。例如,细胞因子风暴可能导致脑部肿胀,而血液过度凝结的趋势可能引发中风。现在的挑战是,在工作人员专注于挽救生命的时候,甚至只是做一个简单的神经学评估(如诱发呕吐反射或运送患者进行脑部扫描)都有传播病毒的风险,而这种可能在以前只是一个猜测。
上个月,匹兹堡大学医学中心的神经病学家周雪莉(Sherry Chou)开始组织一个全球联盟,该联盟目前包括50个中心,从已经接受治疗的患者那里收集神经学数据。联盟早期的目标很简单:确定住院病人中神经并发症的发生率,并记录他们的情况。从长远来看,周和她的同事希望收集有关脑部扫描、实验室测试和其他的数据,以更好地了解病毒对包括大脑在内的神经系统的影响。
周推测了一种可能的入侵途径:病毒通过鼻子,然后向上并通过嗅球(解释了有研究报道所说的嗅觉丧失)—连接到大脑。“这是一个听起来不错的理论,”她说。“我们必须证明这一点。”
周补充说,大多数神经系统症状是“同事间的口口相传”。“我不认为任何人,当然也包括我,可以自称为专家。”
感染肠道
3月初,一名71岁的密歇根州妇女因流血性腹泻,呕吐和腹痛从尼罗河游船返回。起初,医生怀疑她就是得了一种比较常见的胃病,例如沙门氏菌感染。但在她出现咳嗽症状后,医生用鼻腔拭子检测到了她是被新型冠状病毒感染了。根据《美国胃肠病学杂志》(AJG)在线发表的一篇论文显示:如果粪便样本的病毒RNA检测呈阳性,以及内窥镜检查中发现结肠损伤迹象,就表明冠状病毒感染了胃肠道(GI)。
有证据表明,这种新型冠状病毒就像它的“近期”SARS一样,可以感染下消化道的内壁,那里有大量至关重要的ACE2受体,这个病例进一步支持了这一论断。在多达53%的患者粪便样本中发现了病毒RNA。在《胃肠病学》(Gastroenterology)杂志上发表的一篇论文中,一个中国团队报告说在一名COVID-19患者的活检组织中发现了该病毒在胃,十二指肠和直肠细胞中的蛋白质外壳。贝勒医学院的病毒学家Mary Estes说:“我认为它可能确实会在胃肠道中复制。”
AJG联合主编洛杉矶的Cedars-Sinai医学中心的Brennan Spiegel说,最近的报告表明多达一半的患者(平均在整个研究中大约有20%)会经历腹泻。 Spiegel等人说,GI症状不在CDC的COVID-19症状列表中,这可能导致某些COVID-19病例没有被检测到。“如果你的主要症状是发烧和腹泻,你就不会进行COVID检查”北加州凯撒医疗机构的道格拉斯·科利如是说,他是《胃肠病学》的共同编辑。
病毒在消化道的存在增加了其通过粪便传播的令人不安的可能性。但目前还不清楚粪便中是否含有完整的、传染性的病毒,还是只含有RNA和蛋白质。爱荷华大学的冠状病毒专家Stanley Perlman说,迄今为止,“我们没有证据”表明粪便传播是一条很重要的途径。美国疾病控制与预防中心表示,根据SARS和导致中东呼吸综合征病毒(新型冠状病毒的另一个危险近亲)的经验,COVID-19通过粪便传播的风险可能较低。
肠道并不是疾病在体内传播的终点。例如,多达三分之一的住院病人患结膜炎-眼睛发红、流泪,尽管还不清楚这种病毒是否会直接侵入眼睛。其他报告则显示病毒导致肝损伤:在中国两个住院中心的COVID-19患者中,超过一半的人体内的酶水平升高,这表明肝或胆管受到了损伤。但是一些专家告诉《科学》杂志,病毒的直接入侵不太可能是罪魁祸首。他们说,身体机能衰竭时发生的其他事件,如药物或免疫系统超负荷,更有可能导致肝损伤。
以上这些还只是COVID-19对人体造成的破坏的大概。要想弄清楚它的影响范围,以及它可能引发的一系列心血管和免疫系统的级联效应,将需要花费多年的艰苦研究。随着科学的飞速发展,从显微镜下的组织探测到病人身上的药物测试,人们希望找到一种比能使世界都偏离原来的轨道的病毒更加“狡猾”的治疗方法。
See you tomorrow

